1. 競合的な小脳シナプス回路発達の分子機構 (1)
正常な神経機能は、正確で精緻な投射関係を備えたシナプス回路形成を基盤として成立する。しかし、生まれたばかりの動物のシナプス回路は過剰で重複が多く、その精緻化には生後発達過程における活動依存的なシナプスの 強化/除去過程が不可欠である。この概念は、主に、左右眼からの視覚線維が視覚野において分離投射する優位眼球柱の形成発達が、片眼遮断による神経活動奪取や、グルタミン酸受容体のアンタゴニスト投与により阻害されるという実験事実を基盤として確立した。これにより、神経活動がグルタミン酸受容体の活性化を介して、未熟な回路の精緻化を促すものと広く考えられるようになった。しかし、シナプス回路レベルで、活動依存的なシナプス回路網発達を促す分子的実体についてはほとんど不明であった。
グルタミン酸受容体のクローニングの幕開けとともに、私はその脳内遺伝子発現解析に着手した。ちょうど、この研究を始めた 1992年は、井上芳郎教授が担当する北大解剖学第1講座の助教授として、津軽海峡を渡って北大に赴任した年である。同時に、京都大学の中西重忠教授や新潟大学脳研究所の三品昌美教授らがNMDA受容体サブユニットを世に送り出した画期的な年でもあった。遺伝子発現解析から将来につながる何かを見出したいと祈るような気持ちで、来る日も来る日もin situハイブリダイゼーションを行う 「ゼロからの出発」であった。GluRδ2は、その過程において解析したグルタミン酸受容体遺伝子の1つで、小脳プルキンエ細胞に特異的な分子であった。GluRδ2遺伝子ノックアウトマウスの形態解析を契機として、小脳シナプス回路発達に関する一連の神経解剖学的研究に手を染めることとなった。
1.1. プルキンエ細胞と小脳運動機能
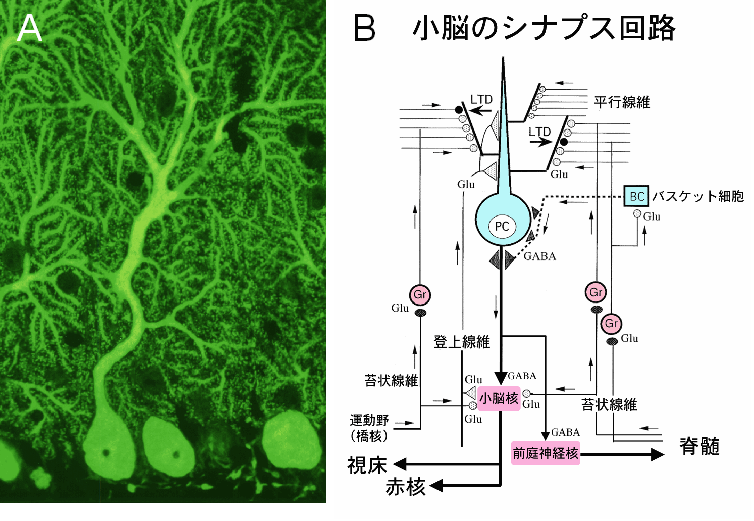
小脳プルキンエ細胞は、その特徴的な扇型の樹状突起を矢状方向に広げ、シナプスを介して大量の神経情報を受取っている(図1)。これらの入力情報は、平行線維と登上線維という2種の興奮性入力線維からのグルタミン酸の放出と、プルキンエ細胞上に発現する グルタミン酸受容体の活性化という分子細胞機構により伝達・処理される。平行線維は小脳顆粒細胞の軸索で、苔状線維を経由して 運動皮質からの運動プランに関する情報と筋・腱からの感覚情報を運んでくる。平行線維は、プルキンエ細胞の遠位樹状突起を支配し、プルキンエ細胞当たり約10万個ものシナプスを形成するが、平行線維側から見ると1本の平行線維は個々のプルキンエ細胞に対して 1つか2つのシナプスしか形成しない。一方、登上線維は延髄下オリーブ核からの投射軸索で、運動機能の向上や円滑化に不可欠な 誤差信号をプルキンエ細胞に運んでくる。成熟脳では1個のプルキンエ細胞はたった1本の登上線維により支配されている。しかし、単一支配とはいえ、プルキンエ細胞の近位樹状突起に巻き付きながら数百にも及ぶシナプスを形成するため、その登上線維の発火は支配するプルキンエ細胞に対して'全か無か'の強い脱分極刺激を与える。その結果、プルキンエ細胞膜上の 電位依存性カルシウムチャネルが活性化され、大量の細胞外カルシウムが流入する。小脳長期抑制は、登上線維と同期して発火した 平行線維シナプスの伝達効率が長期に渡って低下するシナプス可塑性現象で、伊藤らにより発見された。この現象は、登上線維が教師役となって誤った平行線維シナプス回路を抑圧することにより機能的な小脳情報処理回路にする細胞基盤であると考えられている。長期抑制が小脳の運動学習機能の細胞基盤と考えられていることから、ここに「高次脳機能(運動学習)-シナプス可塑性(長期抑制)-分子(グルタミン酸受容体)」 の図式からなる作業仮説が誕生し、プルキンエ細胞に選択的なGluRδ2の分子機能に注目が集まった。
1.2. グルタミン酸受容体GluRδ2と平行線維シナプス形成
現在までに、17種に及ぶイオンチャネル型グルタミン酸受容体のサブユニットが単離・同定されている。その構造的相同性および薬理学的特性から、4種がAMPA型受容体、5種がカイニン酸型受容体、7種がNMDA型受容体の構成サブユニットに 分類されている。GluRδ2は、GluRδ1とともにイオンチャネル活性を示さないため、従来の薬理学的分類を適用できないサブユニットであり、グルタミン酸をリガンドとする受容体であるのかどうかすら不明である。GluRδ2は、日本では三品教授らがドイツではSeeburg博士らが、小脳プルキンエ細胞にほぼ特異的な分子であることを報告した(Araki et al., 1993; Lomeli et al., 1993)。その後、この分子が、平行線維シナプスに選択的で登上線維シナプスには存在しないという事実も明らかになった(Takayama et al., 1995; Landsend et al., 1997)。1995年、三品教授らのグループはGluRδ2欠損マウスを作成し、その興味深い表現型を報告した(Kashiwabuchi et al., 1995)。GluRδ2欠損マウスは、重篤な運動失調症状を呈し、回転棒に乗せるとすぐに落下し、協調運動に障害があった。シナプス回路を調べた結果、平行線維シナプスが減少し、このシナプスに発現すべき長期抑制も消失していた。また、登上線維による支配も、幼若型である多重支配のまま残存していた。これらの表現型から、GluRδ2はシナプスの形成・成熟・可塑性およびこれらを基盤として発現する高次脳機能を制御する重要な分子であることが実証された。この分子が平行線維シナプスに特異的であることから、この分子の機能本体は平行線維シナプス形成にあると考え、それを証明する形態学的解析を始めることにした。ちょうどその頃、電子顕微鏡の経験があり電顕解析を喜々としてこなす耳鼻科の 大学院2年生の栗原秀雄君が、解剖学教室にやってきた。迷わず、GluRδ2欠損マウスの小脳形態解析を研究テーマとし、皮質各層の面積、プルキンエ細胞や顆粒細胞の数、スパインの密度や大きさ、シナプス結合の有無など、定量形態学を駆使して解析を行った。栗原君の解析技術は、mGluR1シグナル伝達系が登上線維の単一支配化に必須であるという一連の先駆的研究で世界の注目を集めることになる 狩野方伸教授との共同研究においても役立った(Kano et al., 1995, 1997, 1998; Offermanns et al., 1997)。
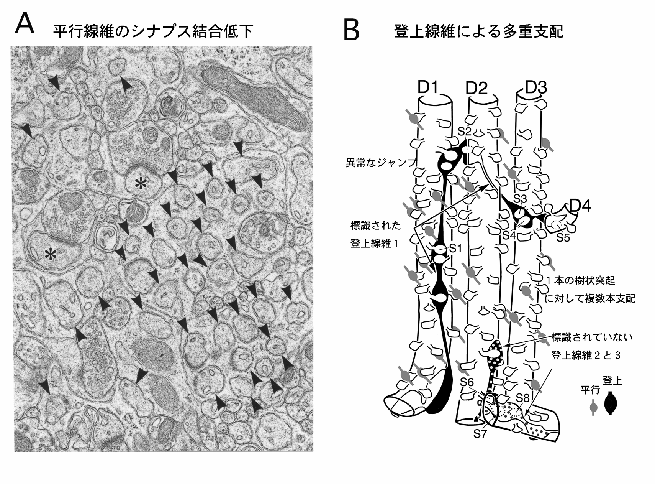
重篤な小脳失調の割には、GluRδ2欠損マウスの小脳組織像やスパイン(棘突起)形成も含めたプルキンエ細胞の形態分化はおおむね正常で、小脳のサイズが若干小さくなる程度であった(Kurihara et al., 1997)。電子顕微鏡で観察すると、シナプス結合を持たないスパインが 多数出現しており、一枚の電顕写真からその遺伝子型を判別できる程の強い表現型であった(図2A)。連続電顕により、1つ1つのスパインがシナプス結合をしているかどうかを調べてみたところ、平行線維とシナプスを形成するスパインの割合 (結合率)は63%で、残る37%はシナプス結合を持たないフリースパインであった。これに対し、野生型の結合率は100%であった。この違いが主な原因となって、プルキンエ細胞当たりの平行線維シナプス数は野生型マウスの約半分にまで減少した。また、GluRδ2のスパイン局在化は平行線維シナプスが著明な増加を遂げる生後第2週に一致して起こる(Takayama et al., 1996)。生後第1週では両方のマウスとも70数%とシナプス結合率はともに低く、生後第2週になると野生型ではほぼ100%の結合率に上昇し 欠損マウスではむしろ低下することも明らかになった。GluRδ2に特徴的なもう一つの表現型は、プレシナプスとポストシナプスの ミスマッチである。シナプス結合を有している平行線維シナプスの中には、平行線維終末のアクティブゾーンよりもプルキンエ細胞スパインの シナプス後膜肥厚部の方が長くなるミスマッチシナプスがしばしば観察される。これらの事実は、平行線維シナプスに特異的なGluRδ2は、平行線維とプルキンエ細胞の間のシナプス結合性の強化と調整に寄与する分子機構であることを示している。この分子機能により、生後第2週を中心に作り出される莫大な数の平行線維とスパインを安定的で機能的なシナプス結合へと導き、小脳情報処理に十分なシナプス数の形成を保障することになる。
最近、平行線維シナプス形成の研究に関して、次のような進展が見られた。誘導型GluRd2欠損マウスを作成し、正常なシナプスが完成した成体期にこの分子の欠損を誘導した。シナプスのGluRd2発現量の減少の時間的推移と一致して、樹状突起の遠位部にフリースパインが出現・増加し、ミスマッチが生じた(Takeuchi, Miyazaki et al., 2005)。従って、成体期においてもGluRd2は平行線維シナプスの結合維持に不可欠な分子機構であることが明かになった。興味深いことに、このようなGluRd2欠損マウスと相同な表現型は、顆粒細胞に選択的発現をする分泌性分子Cbln1(セレベリン1)の 遺伝子欠失により生じることも見いだした(Hirai et al., 2005)。今後、顆粒細胞側のCbln1とプルキンエ細胞側のGluRd2がどのような シグナル経路の中で接点を有しているのか、そしてこれらがどのようなメカニズムにより平行線維シナプスの形成維持に関与しているのか などを明らかにする必要がある。
1.3. GluRδ2と登上線維の単一神経支配確立
平行線維シナプスが減少する自然発症ミュータントやX線照射などの実験動物では、登上線維による神経支配様式が幼若型である 多重神経支配のまま残存するという共通した表現型を生じる。これが根拠となって、登上線維の単一支配には平行線維シナプス形成が 不可欠であるという概念が確立した。しかし、従来のモデル動物では、顆粒細胞や平行線維シナプス数の減少が著しく、小脳の組織構築やプルキンエ細胞自体も著明な退行性変化を起こすため、登上線維によるプルキンエ細胞支配の多重支配に関する 形態学的解析はほとんどなされてこなかった。このため、どうして平行線維シナプス形成が障害されると、余剰な登上線維が除去されなくなるのか、という点が不明なままであった。GluRδ2は元々登上線維シナプスに発現していないため その欠失が登上線維支配に直接的な影響をあたえる可能性は低いこと、GluRδ2欠損マウスではほぼ正常な細胞構築と樹状突起形態を 保有していながら登上線維の多重支配が高頻度に起こっていることから(Kashiwabuchi et al., 1995; Kurihara et al., 1997)、GluRδ2欠損マウスは平行線維シナプス減少が原因となって登上線維の多重支配残存が起こる絶好のモデルと考えた。そこで、平行線維支配が弱まった状況で生じる登上線維の多重支配様式の解明を、次の研究ターゲットと決めた。
登上線維支配の解析法として、登上線維の電気刺激によるプルキンエ細胞の電気生理学的応答を調べる機能的方法と、下オリーブ核への順行性トレーサー注入(神経標識法)による形態学的方法の2つがある。前者は、個々のプルキンエ細胞が 何本の登上線維により支配されているかという数量的解析に優れている。また、登上線維刺激に伴うカルシウム濃度上昇をイメージングする ことにより、空間的情報も得られる。一方、神経標識法は、組織切片上で直接登上線維を可視化するため、光顕および電顕による詳細な形態解析が可能である。さらに、シナプス小胞にグルタミン酸を充填する小胞性グルタミン酸トランスポーターが 最近同定され、そのうちVGLUT2 が登上線維終末/VGLuT1が平行線維終末と、使い分けられていることがわかった。そこで、VGLUT2に対する免疫組織化学が、第3の登上線維解析法となり、これらの3種の方法をGluRδ2欠損マウスの解析に適用した。電気生理学的解析は狩野研の橋本浩一君が、神経標識による解析を北大第1解剖に所属する市川量一君が担当した。後に、P/Q型カルシウムチャネルの解析を担当することになる当時大学院生であった宮崎大輔君も、VGLUT2 による登上線維終末標識により GluRδ2欠損マウスの解析に参加した。
理化学研究所の端川勉先生の下で登上線維のトレーサー標識を指導していただき、市川君はまず光顕レベルで、登上線維支配の遠位拡大がGluRδ2欠損マウスで起きていることを明らかにした。野生型では、登上線維は近位樹状突起のみを支配するため、登上線維終末は小脳分子層の約80%に分布し、遠位樹状突起のみからなる表層の20%は登上線維の及ばない空白ゾーンとなる。ところが、GluRδ2欠損マウスでは、本来平行線維が支配する遠位樹状突起にまでその支配領域を広げる結果、登上線維は分子層のほぼ全域に分布していた。しかし、この遠位化がわかっても、登上線維の多重支配がどのようなものかは全くわからず 頭を抱えた。妙案も浮かばないため、百数十ミクロンメートルある小脳分子層から連続電顕切片を作成し(切片の厚さを0.1ミクロンメートルとすれば 千数百枚)、神経標識された登上線維がどのように樹状突起を支配しているのか立体再構築してみればわかるかもしれないと考え、その後3年余におよぶ連続電顕解析を始めることにした。この賭けは、見事に的を射た(Ichikawa et al., 2002)。
この欠損マウスでは、遠位樹状突起に多数のフリースパインが出現していることは前述した。興味深いことに、このフリースパインを横取りする形で登上線維はその支配領域を遠位樹状突起へと拡大していたのである。このような横取りは、登上線維が近位樹状突起を登上する途中で同一プルキンエ細胞の遠位樹状突起上のフリースパインに対して起こることが多い。さらに、登上線維が遠位樹状突起まで到達しこれを支配した後、今度は周囲の遠位樹状突起に飛び移ってそこのフリースパインを 支配するという、野生型では決して観察されない異常なジャンピングも起きた(図2B)。連続電顕をもう一度戻って飛び移った 先の樹状突起の近位部を調べてみると、標識トレーサーを持たない別の登上線維が支配していることが判明した。つまり、GluRδ2欠損マウスにおける登上線維の多重神経支配は、近隣の樹状突起に生じたフリースパインの横取り的支配により生じていたのである。このような多重神経支配は、立体再構築を行った欠損マウスの3例全てに観察され、野生型マウスでは全く見られなかった。さらに、この形態学的結果は、金沢大学の狩野教授らのグループが行ったカルシウムイメージングによる解析結果とも一致した (Hashimoto et al.,2001)。主要な登上線維への電気刺激は樹状突起の広範な領域でカルシウム上昇を引き起こしたが、余剰な登上線維への刺激では一部の遠位樹状突起での局所的上昇にとどまっていた。これらの所見から、平行線維シナプスが形成不全になると 遠位樹状突起には空席となったシナプス後部基質が生じ、これに向って登上線維支配の遠位化が起こり、それが周囲のプルキンエ細胞にまで 及ぶことにより多重支配が起こるのである(図3)。この事例は、どのようにして登上線維の多重支配が起こるのかを電子顕微鏡レベルで 実証した世界で最初の例となった。完璧な平行線維シナプス形成を保障することは、同時に、登上線維支配の過度な遠位化を抑止することにもなる。それがGluRδ2に与えられた分子機能なのであろう。もしそうであるならば、登上線維側にもその支配を強化し平行線維支配の過度な 近位化を抑止している分子機構があるはずである。

 研究内容
研究内容